Dall’ESC di Monaco di Baviera (agosto 2018) e simultanea pubblicazione nel NEJM un risultato interlocutorio che non aiuta a fare chiarezza in un’area di grande incertezza.
Brevemente, mentre è ben noto che, soprattutto in assenza di adeguata tromboprofilassi intraospedaliera, molti pazienti di area internistica sono esposti ad un rischio di tromboembolismo venoso (TEV) che perdura per alcune settimane dopo la dimissione, i tentativi fin qui fatti con vecchi e nuovi farmaci per ridurne la frequenza hanno dato risultati deludenti. Il vantaggio conferito dal proseguimento dell’eparina a basso p.m. o dalla somministrazione di rivaroxaban fino a 40 giorni dall’ospedalizzazione è stato vanificato da un inatteso rischio emorragico. E l’apixaban non ha nemmeno mostrato per questa indicazione una superiore efficacia nei confronti di 10 giorni di eparina a basso p.m., che rappresentano a tutt’oggi lo standard della prevenzione del TEV in area internistica, per lo meno nei pazienti che sulla base di score che sono stati da tempo identificati (in primis, il Padua Prediction Score) risultano a rischio di tali complicazioni. Come esaurientemente riportato nel poster del 10 maggio, al quale rinvio per maggiori dettagli, risultati favorevoli sono stati sin qui riportati per il solo betrixaban, ma il farmaco non è ancora disponibile sul mercato, né per questa né per altre indicazioni.
Ritorniamo al rivaroxaban, oggetto del MARINER. Lo studio precedente (il MAGELLAN), che aveva testato il rivaroxaban alla dose di 10 mg/die per 40 giorni nei confronti dell’enoxaparina 4000 U/die per 10 giorni, aveva dato un risultato deludente a ragione dell’inatteso rischio emorragico1. E poco conta che analisi successive lo abbiano rivalutato nel sottogruppo di pazienti con malattie infettive2. I promotori del MARINER hanno pertanto progettato uno studio che, partendo dai risultati del precedente, si focalizzasse su pazienti a maggiore probabilità di un favorevole rapporto beneficio/rischio e prevedesse una congrua riduzione del dosaggio (25%) in pazienti con insufficienza renale moderata. Hanno pensato inoltre di ridurre il rischio di un nuovo insuccesso randomizzando i pazienti a farmaco o placebo solo al momento della dimissione dall’ospedale, cioè al termine di un periodo di profilassi farmacologica con enoxaparina di durata variabile, dipendente dalla durata del ricovero, e comunque non inferiore a 3 giorni e non superiore a 10. Allo scopo infine di raggiungere un obiettivo di solida evidenza hanno identificato quale endpoint primario di efficacia i soli eventi tromboembolici sintomatici in combinazione con i decessi in cui non fosse escludibile l’embolia polmonare quale causa del decesso stesso.
Erano eleggibili per lo studio pazienti di età superiore a 40 anni che fossero stati ricoverati a causa di scompenso cardiaco (con frazione di eiezione < 45%), insufficienza respiratoria acuta o riacutizzazione di BPCO, ictus ischemico acuto o malattia infettiva/infiammatoria acuta (inclusiva di affezioni reumatiche) a condizione che fosse presente uno score IMPROVE di almeno 4 od anche uno score 2-3 in presenza di un DD basale superiore a 2 volte il range superiore di normalità in accordo con il test utilizzato. I pazienti reclutati furono assegnati a ricevere rivaroxaban 10 mg/die (ridotti a 7.5 mg/die nei soggetti con insufficienza renale moderata) o placebo per 45 giorni.
Dopo l’inclusione di 12019 pazienti l’end-point primario di efficacia fu raggiunto nel periodo previsto di osservazione (45 giorni) in 50 dei 6007 (0.83%) pazienti randomizzati al rivaroxaban ed in 66 dei 6012 (1.10%) assegnati al placebo (HR, 0.76; 95% CI: 0.52 – 1.09; P = 0.14) (Fig. 1). Le sole recidive sintomatiche non fatali di TEV (end-point secondario di efficacia) risultarono ridotte in modo statisticamente significativo (0.18% vs 0.42%; HR = 0.44; 95% CI: 0.22 – 0.89) (Fig. 2). Episodi di emorragia maggiore, definiti in base alla classificazione ISTH, si manifestarono in 17 de 5982 pazienti (0.28%) randomizzati al rivaroxaban ed in 9 dei 5980 (0.15%) assegnati al placebo (HR = 1.88; 95% CI: 0.84 – 4.23).

Figura 1. Incidenza cumulativa di eventi tromboembolici in pazienti assegnati al rivaroxaban ed al placebo
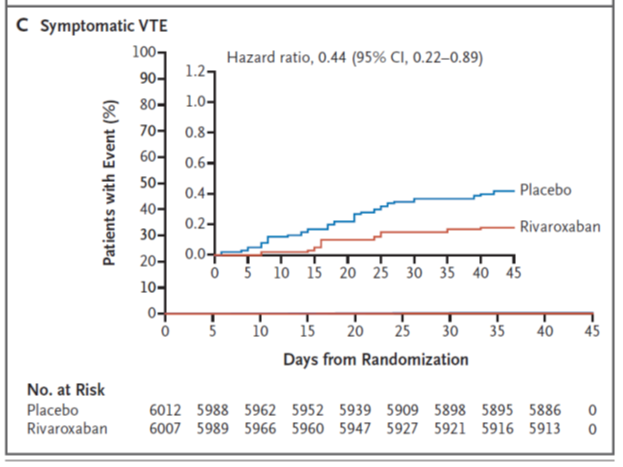
Figura 2. Incidenza cumulativa di TEV sintomatico non fatale in pazienti assegnati al rivaroxaban ed al placebo
Commento. Cronaca di un insuccesso annunciato. Infatti:
1) Numerosi e qualificati studi recenti (in primis quello che ha lanciato il Padua Prediction Score) avevano dimostrato che nei pazienti di area medica ad elevato rischio tromboembolico che abbiano ricevuto una corretta tromboprofilassi farmacologica durante il periodo di ricovero il rischio di eventi tromboembolici sintomatici ed ancor più quello di morte per EP nelle settimane successive alla dimissione non differisce da quello accertabile in pazienti a basso rischio tromboembolico. Ecco la ragione della bassa frequenza di eventi tra i soggetti assegnati al placebo, che rendeva proibitiva la probabilità di dimostrare un vantaggio per il farmaco. Tanto più che la (giustificata) inclusione tra gli end-points di efficacia della mortalità nei casi in cui non fosse escludibile l’EP ha provocato l’inevitabile censimento di decessi in gran parte dovuti a cause non prevenibili dal rivaroxaban.
2) Si sarebbe potuto ovviare alla limitazione di cui al punto 1 includendo tra gli endpoints primari di efficacia lo sviluppo di TVP prossimale accertabile con ecografia venosa, anche se asintomatica. La TVP sintomatica è la punta di un iceberg. Dietro ad ogni evento sintomatico si nascondono almeno 10 eventi asintomatici, che in un terzo dei casi coinvolgono in forma più o meno estesa il circolo prossimale. Dato che episodi sintomatici di TEV si sono verificati tra i pazienti arruolati al rivaroxaban con frequenza significativamente inferiore che tra i soggetti assegnati al placebo, l’inclusione tra gli endpoints delle TVP prossimali asintomatiche avrebbe probabilmente spostato la bilancia a favore del rivaroxaban, e ora staremmo commentando un risultato diverso.
3) Al gruppo piuttosto numeroso di pazienti con insufficienza renale moderata è stato dato un dosaggio ridotto (7.5 mg/die) di rivaroxaban. Ed in tale gruppo la performance del rivaroxaban è stata nettamente inferiore a quella dei pazienti che avevano ricevuto 10 mg. Perché tale riduzione del dosaggio? Perchè negare a tali pazienti per 45 giorni una dose (10 mg) che è inferiore del 50% a quella (15 mg) tollerata dai soggetti fibrillanti per anni? E’ vero che l’insufficienza renale accresce il rischio emorragico, ma accresce di tanto più il rischio tromboembolico.
Conclusione. Il NEJM giustamente nega qualsiasi implicazione favorevole dei risultati dello studio. Oggi le cose non stanno più come una volta, quando si andava a “pescare” tra i risultati di uno studio quello o quelli più convenienti. Oggi si dichiara un obiettivo e poi non si cambiano più le carte in tavola. Gli autori hanno dichiarato un obiettivo primario che non è stato raggiunto. Dunque, nuovo insuccesso per il rivaroxaban, che si aggiunge a quelli del NAVIGATE ESUS e del TRAPS di cui parleremo nel prossimo post. Certamente il farmaco non sarà registrato dagli enti regolatori per questa indicazione. Ma ho seri dubbi che si possa concretamente parlare di un fallimento del farmaco.
Bibliografia
- Cohen AT, Spiro TE, Büller HR, Haskell L, Hu D, Hull R, Mebazaa A, Merli G, Schellong S, Spyropoulos AC, Tapson V; MAGELLAN Investigators. Rivaroxaban for thromboprophylaxis in acutely ill medical patients. N Engl J Med 2013;368:513-23.
- Cohoon KP, De Sanctis Y, Haskell L, McBane RD, Spiro TE. Rivaroxaban for thromboprophylaxis among patients recently hospitalized for acute infectious diseases: a subgroup analysis of the MAGELLAN study. J Thromb Haemost 2018;16:1278-87.
- Spyropoulos AC, Ageno W, Albers GW, Elliott CG, Halperin JL, Hiatt WR, Maynard GA, Steg PG, Weitz JI, Suh E, Spiro TE, Barnathan ES, Raskob GE; MARINER Investigators. Rivaroxaban for thromboprophylaxis after hospitalization for medical illness. N Engl J Med 2018 Aug 26. doi: 10.1056/NEJMoa1805090.





