C’era grande attesa per i risultati di due studi ‘gemelli’, l’AVERT ed il CASSINI, programmati alcuni anni fa per testare il ruolo dei nuovi anticoagulanti orali diretti (NAO) per questa indicazione.
Entrambi sono stati presentati all’ASH 2018, ma solo l’AVERT pubblicato simultaneamente nel NEJM1. Pertanto commenterò solo questo. Prima di commentare il CASSINI mi riservo di leggere la pubblicazione in extenso.
Mentre la tromboprofilassi viene raccomandata con sistematicità per i pazienti neoplastici esposti al rischio di complicanze tromboemboliche venose (TEV) in seguito alla ospedalizzazione ed agli interventi di chirurgia maggiore, il suo ruolo nella protezione da complicanze in pazienti ambulatoriali candidati alla chemioterapia è meno ben definito.
Il beneficio conferito dall’eparina (standard od a basso peso molecolare) è incerto. Le linee guida al riguardo sono evasive, e dissuadono dalla applicazione generalizzata della protezione antitrombotica, a maggior ragione per gli inconvenienti emorragici, tanto più inevitabili nelle circostanze in cui calano le piastrine, e per la lunga durata dei periodi a rischio, che finisce per rappresentare un ostacolo ad una protezione conferita per via parenterale. Senza dimenticare i costi delle eparine ed il fisiologico calo dell’aderenza e della persistenza alla terapia eparinica, già ben dimostrato in pazienti neoplastici che ne necessitano per la protezione antitrombotica a lungo termine dopo un episodio di TEV. C’era pertanto grande attesa per i due nuovi trials per testare il valore dei NAO.
AVERT. Trial clinico in doppio-cieco controllato vs placebo in cui 563 pazienti con neoplasie di varia tipologia con un punteggio > 2 dello score di Khorana e candidati ad un nuovo ciclo di polichemioterapia di almeno tre mesi sono stati randomizzati a ricevere, in aggiunta alla terapia antineoplastica, apixaban 2.5 mg x 2/die o placebo per sei mesi, prescindendo dalla durata della chemioterapia.
In realtà poi il trattamento è stato interrotto precocemente in molti pazienti, cosicché la durata mediana della profilassi è stata dell’ordine di circa 5 mesi in entrambi i gruppi. L’end-point primario di efficacia era una combinazione di trombosi venosa profonda (TVP) prossimale degli arti sintomatica o diagnosticata accidentalmente, embolia polmonare (EP) sintomatica o diagnosticata accidentalmente e morte attribuibile ad EP (od in cui comunque la complicanza embolica non potesse essere esclusa) in tutto l’arco dei 180 giorni prescindendo dalla durata del trattamento. L’end-point primario di sicurezza era l’emorragia maggiore, definita secondo i criteri ISTH, in tutto l’arco dei 180 giorni prescindendo dalla durata del trattamento, ed a sua volta stadiata in 4 gradi di severità, in cui i gradi 3 e 4 corrispondono rispettivamente ad emorragie critiche e mortali.
I due gruppi erano ben bilanciati per età, sesso (maschile nel 40% dei pazienti), etnia, tipologia e severità delle neoplasie (in gran parte neoplasie ginecologiche, pancreatiche e polmonari), score di Khorana all’ingresso (in più del 60% score 2 in entrambi i gruppi), ECOG performance status e precedente tromboembolismo venoso (3% dei pazienti in entrambi i gruppi). L’end-point primario di efficacia fu raggiunto in 12 dei 288 pazienti (4.2%) randomizzati all’apixaban ed in 28 dei 275 (10.2%) assegnati al placebo (HR=0.41; 95% CI: 0.26-0.65; P<0.001) [Figura 1].
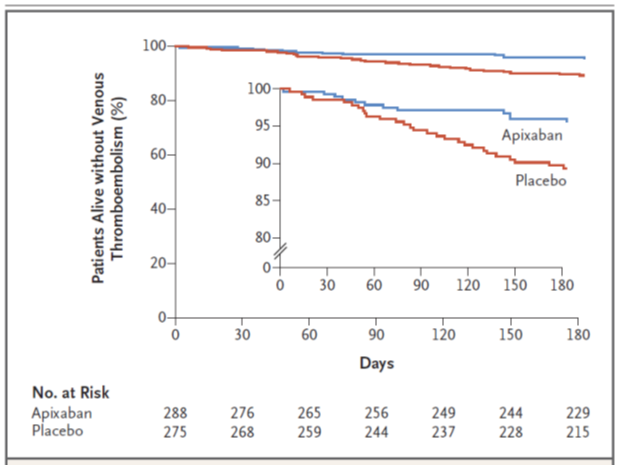
Figura 1. Incidenza cumulativa dell’endpoint primario di efficacia nei pazienti all’apixaban e al placebo
Emorragie maggiori si verificarono in 10 pazienti (3.5%) randomizzati all’apixaban ed in 5 (1.8%) assegnati al placebo (HR=2.00; 95% CI: 1.01-3.95; P= 0.046), e furono critiche o fatali in 3 pazienti (1 in apixaban e 2 in placebo) [Figura 2]. Emorragie minori di rilevanza clinica si registrarono in lieve eccedenza tra i pazienti assegnati all’apixaban (7.3 vs 5.5%; HR=1.28; 95% CI: 0.89–1.84). La mortalità globale, largamente imputabile all’evoluzione della neoplasia, fu simile nei due gruppi con una lieve eccedenza tra i pazienti assegnati all’apixaban (12.2 vs 9.8%).
Durante il solo periodo di trattamento (quindi escludendo in un’analisi secondaria che era stata predefinita gli eventi accaduti dopo la sospensione del farmaco), l’end-point primario di efficacia fu raggiunto in 3 dei 288 pazienti (1.0%) randomizzati all’apixaban ed in 20 dei 275 (7.3%) assegnati al placebo (HR=0.14; 95% CI: 0.05-0.42). Ed emorragie maggiori rispettivamente in 6 (2.1%) e 3 (1.1%) (HR=1.89; 95% CI: 0.39-9.24).
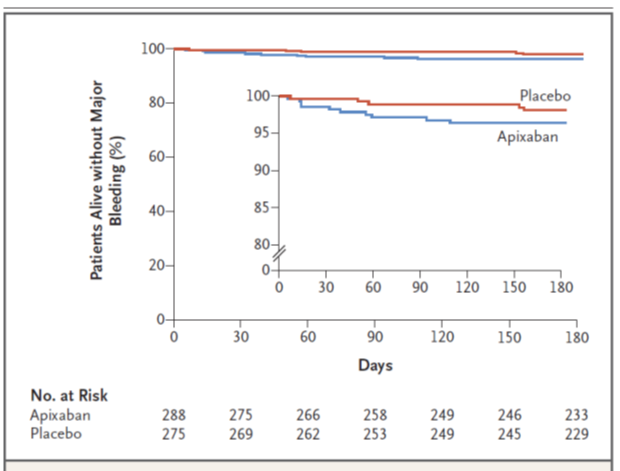
Figura 2. Incidenza cumulativa di emorragie maggiori in pazienti assegnati all’apixaban o al placebo
Commento. Siamo davanti ad un risultato di grande valore. Per la prima volta un farmaco antitrombotico per via orale previene il TEV onnicomprensivo scatenato dalla polichemioterapia in pazienti neoplastici di varia tipologia.
Il risultato è sovrapponibile a quello ottenuto in un recente passato da uno studio di più ampie proporzioni (il SAVE-ONCO in più di 3000 pazienti) in pazienti con simili caratteristiche condotto con una eparina a bassissimo pm, la semuloparina2. Con questo condivide l’entità della riduzione del TEV in assenza di aumento del rischio emorragico. È ben vero che l’analisi primaria di sicurezza penalizza l’apixaban, ma la differenza scompare quando l’analisi viene condotta nel solo periodo di trattamento.
Ci si sarebbe aspettati il contrario, ne esce ben evidente il ruolo del caso in un contesto, qual è quello delle neoplasie in fase evolutiva, in cui il rischio tromboembolico e quello emorragico fanno inevitabilmente parte della storia naturale di questi pazienti4. Con il SAVE-ONCO condivide anche l’inefficacia protettiva nei confronti della mortalità. Questo fu essenzialmente il motivo che indusse la FDA ad esprimere delle riserve nei confronti dei risultati del SAVE-ONCO e l’azienda produttrice a non commercializzare il farmaco. Speriamo non accada la stessa cosa con i NAO.
Non si vede infatti come potrebbe un antitrombotico (a basso dosaggio) proteggere dalla evoluzione sfavorevole neoplasie in stadio avanzato. Ci fu un periodo in passato in cui si credette in una proprietà ‘miracolistica’ dell’eparina a basso pm, che poi studi impostati ad hoc non hanno confermato3.
A sostanziale parità di profilo benefico/rischio nei confronti dell’eparina a basso pm, quale emerge dallo studio AVERT, si concretizzano però tutti quei vantaggi in termini di maneggevolezza, costo e gradimento dei pazienti a cui abbiamo sopra accennato.
Cos’altro aggiungere? Poche altre considerazioni.
La prima è che i risultati dello studio non sono generalizzabili a tutti i neoplastici candidati alla polichemioterapia ma solo a quelli con score di Khorana di almeno 2, che non abbiano insufficienza renale severa, che non necessitino di farmaci potenzialmente interferenti con l’apixaban, e che non abbiano una piastrinopenia severa.
Va da sé che il subentrare nel corso della terapia di una piastrinopenia obbligherebbe ad una sospensione di durata imprevedibile. Di certo le eparine hanno una flessibilità di dosaggio che meglio si adatta a tali circostanze, si potrà farvi ricorso in tali eventualità. Senza dimenticare che la chemioterapia fa vomitare. Non sempre i pazienti sono nelle condizioni di prendere pillole per os. Anche in tal caso si ripiegherà per uno o più giorni sulle eparine. Insomma, qualche problemino inevitabilmente c’è.
Ma il passo in avanti compiuto dall’AVERT è grande e va nella direzione giusta. Questa volta gli estensori delle linee guida ed i dirigenti degli enti regolatori non potranno non tenerne conto. Soprattutto in considerazione del fatto che, sulla base dei risultati preliminari presentati all’ASH, lo studio gemello CASSINI va nella stessa direzione.
Ma ne parleremo quando sarà pubblicato.
Bibliografia
- Carrier M, Abou-Nassar K, Mallick R; AVERT Investigators. Apixaban to prevent venous thromboembolism in patients with cancer. N Engl J Med 2018 Dec 4. doi: 10.1056/NEJMoa1814468. [Epub ahead of print]
- Agnelli G, George DJ, Kakkar AK, et al; SAVE-ONCO Investigators. Semuloparin for thromboprophylaxis in patients receiving chemotherapy for cancer. N Engl J Med 2012;366:601-9.
- van Doormaal FF, Di Nisio M, Otten HM, Richel DJ, Prins M, Buller HR. Randomized trial of the effect of the low molecular weight heparin nadroparin on survival in patients with cancer. J Clin Oncol 2011;29:2071-6.
- Decousus H, Bourmaud A, Fournel P, et al. Cancer-associated thrombosis in patients with implanted ports: a prospective multicenter French cohort study (ONCOCIP). Blood 2018;132:707-16.





